糖蛋白占人类蛋白质和大多数生物制药产物的50%以上,蛋白质糖基化作为最广泛和最复杂的翻译后修饰(PTM)之一,对调节各种生物过程至关重要。糖蛋白序列的综合分析,包括糖基化位点和相关聚糖结构的深度剖析,是糖蛋白功能研究的关键。液相色谱-质谱法(LC-MS/MS)已成为蛋白质鉴定和翻译后修饰发现的强大工具。与糖蛋白质组学中广泛使用的数据库搜索的策略不同,蛋白质从头测序无需事先了解DNA/氨基酸序列,用于未知蛋白的序列测定。然而,多糖基化位点的复杂性通常会使得质谱很难获得信息丰富的糖肽碎片离子,导致序列覆盖不完整和游离寡糖修饰谱不明确,从而影响从头测序的准确性。
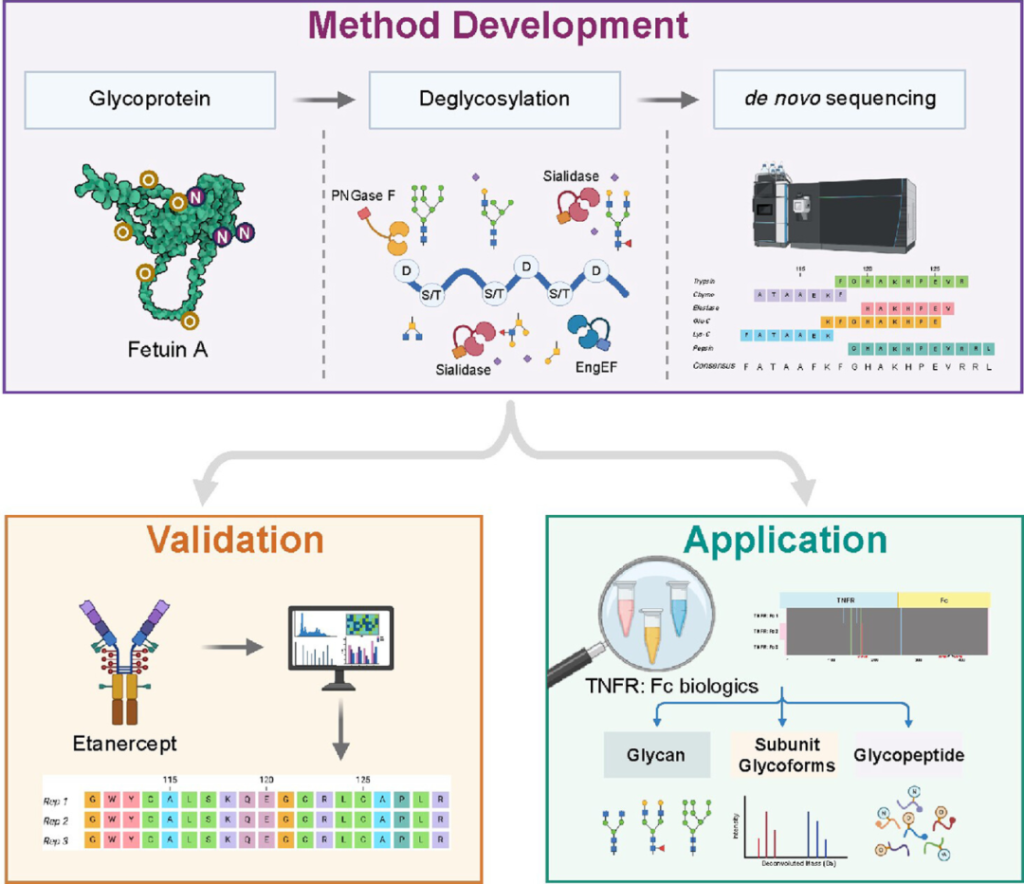
2025年初,上海药物研究所的周虎研究员和文留青研究员联合在Analytical Chemistry期刊联合发表了一种结合质谱蛋白质从头测序技术解码未知糖蛋白的新方法:Decoding Protein Glycosylation by an Integrative Mass Spectrometry-Based De Novo Sequencing Strategy,方案设计见图1。Fetuin-A(UniProt Accession no.P12763)是一种含有唾液酸化 N糖和O糖的常用模型糖蛋白,作者首先基于Fetuin-A,用糖苷酶切除糖链后采集质谱数据,使用PEAKS® AB完成蛋白质序列的自动组装,建立了糖蛋白的从头测序方法,可获得去糖基化蛋白的一级序列。接下来,使用高度复杂的糖基化蛋白药物依那西普来验证该方法的性能。随后,作者应用该方法鉴定了三种未知 TNFR:Fc 融合生物制剂的氨基酸序列,以探索它们与原研药物依那西普的相似性。并且,从N糖基化位点、游离糖、糖蛋白亚单位、糖肽的多个层面进行了深度糖基化表征,以精确定位 N−/ O-糖基化。该方法弥合了从头测序和糖基化修饰分析之间的差距,提供了有关糖蛋白一级结构和糖基化修饰的全面信息,在基础研究和生物制药行业均具有实用价值。
原文链接:https://pubs.acs.org/doi/10.1021/jacsau.4c00960?ref=PDF

